នៅក្នុងវិស័យវេជ្ជសាស្ត្រទំនើប ថ្នាំអង់ទីប៊ីយោទិកបានបង្ហាញថាជាការរីកចម្រើនដ៏សំខាន់បំផុតមួយ ដោយកាត់បន្ថយអត្រាកើតជំងឺ និងអត្រាមរណភាពដែលទាក់ទងនឹងការឆ្លងមេរោគមីក្រូសរីរាង្គយ៉ាងច្រើន។ សមត្ថភាពរបស់ពួកវាក្នុងការផ្លាស់ប្តូរលទ្ធផលគ្លីនិកនៃការឆ្លងមេរោគបាក់តេរីបានពន្យារអាយុកាលរបស់អ្នកជំងឺរាប់មិនអស់។ ថ្នាំអង់ទីប៊ីយោទិកមានសារៈសំខាន់ខ្លាំងណាស់នៅក្នុងនីតិវិធីវេជ្ជសាស្ត្រស្មុគស្មាញ រួមទាំងការវះកាត់ ការដាក់បញ្ចូល ការប្តូរសរីរាង្គ និងការព្យាបាលដោយគីមី។ ទោះជាយ៉ាងណាក៏ដោយ ការលេចចេញនូវភ្នាក់ងារបង្ករោគដែលធន់នឹងថ្នាំអង់ទីប៊ីយោទិក គឺជាកង្វល់កាន់តែខ្លាំងឡើង ដែលធ្វើឱ្យប្រសិទ្ធភាពនៃថ្នាំទាំងនេះថយចុះតាមពេលវេលា។ ឧទាហរណ៍នៃភាពធន់នឹងថ្នាំអង់ទីប៊ីយោទិកត្រូវបានកត់ត្រានៅគ្រប់ប្រភេទនៃថ្នាំអង់ទីប៊ីយោទិក នៅពេលដែលការផ្លាស់ប្តូរមេរោគកើតឡើង។ សម្ពាធជ្រើសរើសដែលបង្កឡើងដោយថ្នាំអង់ទីប៊ីយោទិកបានរួមចំណែកដល់ការកើនឡើងនៃពូជដែលធន់នឹងថ្នាំ ដែលបង្កបញ្ហាប្រឈមយ៉ាងសំខាន់ដល់សុខភាពពិភពលោក។
ដើម្បីប្រយុទ្ធប្រឆាំងនឹងបញ្ហាបន្ទាន់នៃភាពធន់នឹងថ្នាំអង់ទីប៊ីយោទិច វាមានសារៈសំខាន់ណាស់ក្នុងការអនុវត្តគោលនយោបាយគ្រប់គ្រងការឆ្លងមេរោគប្រកបដោយប្រសិទ្ធភាព ដែលកាត់បន្ថយការរីករាលដាលនៃភ្នាក់ងារបង្ករោគដែលធន់នឹងថ្នាំ រួមជាមួយនឹងការកាត់បន្ថយការប្រើប្រាស់ថ្នាំអង់ទីប៊ីយោទិច។ លើសពីនេះ មានតម្រូវការបន្ទាន់សម្រាប់វិធីសាស្ត្រព្យាបាលជំនួស។ ការព្យាបាលដោយអុកស៊ីសែនសម្ពាធខ្ពស់ (HBOT) បានលេចចេញជាមធ្យោបាយដ៏ជោគជ័យមួយនៅក្នុងបរិបទនេះ ដែលពាក់ព័ន្ធនឹងការស្រូបអុកស៊ីសែន 100% នៅកម្រិតសម្ពាធជាក់លាក់សម្រាប់រយៈពេលណាមួយ។ ដោយមានទីតាំងជាការព្យាបាលបឋម ឬការព្យាបាលបំពេញបន្ថែមសម្រាប់ការឆ្លងមេរោគ HBOT អាចផ្តល់ក្តីសង្ឃឹមថ្មីក្នុងការព្យាបាលការឆ្លងមេរោគស្រួចស្រាវដែលបណ្តាលមកពីភ្នាក់ងារបង្ករោគដែលធន់នឹងថ្នាំអង់ទីប៊ីយោទិច។
ការព្យាបាលនេះត្រូវបានអនុវត្តកាន់តែខ្លាំងឡើងជាការព្យាបាលបឋម ឬជម្រើសសម្រាប់ជំងឺផ្សេងៗ រួមទាំងការរលាក ការពុលកាបូនម៉ូណូអុកស៊ីត របួសរ៉ាំរ៉ៃ ជំងឺខ្វះឈាម និងការឆ្លងមេរោគ។ ការអនុវត្តគ្លីនិករបស់ HBOT ក្នុងការព្យាបាលការឆ្លងមេរោគគឺជ្រាលជ្រៅ ដែលផ្តល់នូវគុណសម្បត្តិដ៏មានតម្លៃដល់អ្នកជំងឺ។

ការអនុវត្តគ្លីនិកនៃការព្យាបាលដោយអុកស៊ីសែនសម្ពាធខ្ពស់ក្នុងការឆ្លងមេរោគ
ភស្តុតាងបច្ចុប្បន្នគាំទ្រយ៉ាងរឹងមាំចំពោះការអនុវត្ត HBOT ទាំងជាការព្យាបាលឯករាជ្យ និងការព្យាបាលបន្ថែម ដែលបង្ហាញពីអត្ថប្រយោជន៍យ៉ាងសំខាន់ដល់អ្នកជំងឺដែលឆ្លងមេរោគ។ ក្នុងអំឡុងពេល HBOT សម្ពាធអុកស៊ីសែនក្នុងឈាមសរសៃឈាមអាចកើនឡើងដល់ 2000 mmHg ហើយជម្រាលសម្ពាធអុកស៊ីសែន-ជាលិកាខ្ពស់ជាលទ្ធផលអាចបង្កើនកម្រិតអុកស៊ីសែនជាលិកាដល់ 500 mmHg។ ផលប៉ះពាល់បែបនេះមានតម្លៃជាពិសេសក្នុងការជំរុញការព្យាបាលនៃការឆ្លើយតបរលាក និងការរំខានដល់ចរន្តឈាមតូចៗដែលសង្កេតឃើញនៅក្នុងបរិស្ថាន ischemic ក៏ដូចជាក្នុងការគ្រប់គ្រងរោគសញ្ញា compartment ។
HBOT ក៏អាចប៉ះពាល់ដល់លក្ខខណ្ឌដែលពឹងផ្អែកលើប្រព័ន្ធភាពស៊ាំផងដែរ។ ការស្រាវជ្រាវបង្ហាញថា HBOT អាចទប់ស្កាត់រោគសញ្ញាអូតូអ៊ុយមីន និងការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំដែលបង្កឡើងដោយអង់ទីហ្សែន ដោយជួយរក្សាការអត់ធ្មត់នៃការផ្សាំដោយកាត់បន្ថយចរន្តឈាមនៃកោសិកាឡាំហ្វាស៊ីត និងកោសិកាឈាមស ខណៈពេលដែលកែប្រែការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំ។ លើសពីនេះ HBOTគាំទ្រដល់ការព្យាបាលនៅក្នុងដំបៅស្បែករ៉ាំរ៉ៃ ដោយការជំរុញ angiogenesis ដែលជាដំណើរការដ៏សំខាន់មួយសម្រាប់ការជាសះស្បើយប្រសើរឡើង។ ការព្យាបាលនេះក៏លើកទឹកចិត្តដល់ការបង្កើតម៉ាទ្រីស collagen ដែលជាដំណាក់កាលសំខាន់មួយក្នុងការព្យាបាលរបួស។
ការយកចិត្តទុកដាក់ជាពិសេសត្រូវតែផ្តល់ទៅឱ្យការឆ្លងមេរោគមួយចំនួន ជាពិសេសការឆ្លងមេរោគជ្រៅ និងពិបាកព្យាបាលដូចជា ជំងឺរលាកសរសៃពួររលួយ ជំងឺរលាកឆ្អឹង ការឆ្លងមេរោគជាលិកាទន់រ៉ាំរ៉ៃ និងជំងឺរលាកស្រទាប់ខាងក្នុងបេះដូងដែលឆ្លងមេរោគ។ ការអនុវត្តគ្លីនិកទូទៅបំផុតមួយនៃ HBOT គឺសម្រាប់ការឆ្លងមេរោគស្បែក-ជាលិកាទន់ និងជំងឺរលាកឆ្អឹងដែលទាក់ទងនឹងកម្រិតអុកស៊ីសែនទាប ដែលជារឿយៗបណ្តាលមកពីបាក់តេរីអាណាអេរ៉ូប៊ី ឬបាក់តេរីដែលធន់នឹងថ្នាំ។
១. ការឆ្លងមេរោគជើងសម្រាប់អ្នកជំងឺទឹកនោមផ្អែម
ជើងអ្នកជំងឺទឹកនោមផ្អែមដំបៅជើងគឺជាផលវិបាកដ៏រីករាលដាលក្នុងចំណោមអ្នកជំងឺទឹកនោមផ្អែម ដែលប៉ះពាល់ដល់ប្រជាជនរហូតដល់ 25% នៃចំនួនប្រជាជននេះ។ ការឆ្លងមេរោគច្រើនតែកើតឡើងនៅក្នុងដំបៅទាំងនេះ (មានចំនួន 40%-80% នៃករណី) ហើយនាំឱ្យមានការកើនឡើងនៃអត្រាឈឺ និងស្លាប់។ ការឆ្លងមេរោគជើងទឹកនោមផ្អែម (DFIs) ជាធម្មតាមានការឆ្លងមេរោគពហុមេរោគដែលមានភ្នាក់ងារបង្ករោគបាក់តេរីអាណាអេរ៉ូប៊ីជាច្រើនប្រភេទត្រូវបានកំណត់អត្តសញ្ញាណ។ កត្តាផ្សេងៗ រួមទាំងពិការភាពមុខងារ fibroblast បញ្ហាបង្កើត collagen យន្តការភាពស៊ាំកោសិកា និងមុខងារ phagocyte អាចរារាំងការព្យាបាលរបួសចំពោះអ្នកជំងឺទឹកនោមផ្អែម។ ការសិក្សាជាច្រើនបានកំណត់អត្តសញ្ញាណការចុះខ្សោយនៃអុកស៊ីសែនស្បែកជាកត្តាហានិភ័យខ្លាំងសម្រាប់ការកាត់អវយវៈដែលទាក់ទងនឹង DFIs។
ជាជម្រើសមួយនាពេលបច្ចុប្បន្នសម្រាប់ការព្យាបាល DFI, HBOT ត្រូវបានគេរាយការណ៍ថាជួយបង្កើនអត្រាព្យាបាលដំបៅជើងសម្រាប់អ្នកជំងឺទឹកនោមផ្អែមយ៉ាងច្រើន ដែលក្រោយមកកាត់បន្ថយតម្រូវការកាត់អវយវៈ និងអន្តរាគមន៍វះកាត់ស្មុគស្មាញ។ វាមិនត្រឹមតែកាត់បន្ថយភាពចាំបាច់សម្រាប់នីតិវិធីដែលប្រើធនធានច្រើនដូចជាការវះកាត់បិទស្បែក និងការផ្សាំស្បែកប៉ុណ្ណោះទេ ប៉ុន្តែវាថែមទាំងបង្ហាញពីការចំណាយទាប និងផលប៉ះពាល់តិចតួចបំផុតបើប្រៀបធៀបទៅនឹងជម្រើសវះកាត់។ ការសិក្សាមួយដោយ Chen et al. បានបង្ហាញថា វគ្គ HBOT ច្រើនជាង 10 វគ្គបាននាំឱ្យមានភាពប្រសើរឡើង 78.3% នៃអត្រាព្យាបាលរបួសចំពោះអ្នកជំងឺទឹកនោមផ្អែម។
២. ការឆ្លងមេរោគជាលិកាទន់ដែលរលួយ
ការឆ្លងមេរោគជាលិកាទន់រលួយ (NSTIs) ច្រើនតែជាមេរោគចម្រុះ ដែលជាធម្មតាកើតឡើងពីការរួមបញ្ចូលគ្នានៃបាក់តេរីបង្កជំងឺអេរ៉ូប៊ីក និងអាណាអេរ៉ូប៊ីក ហើយជារឿយៗត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការផលិតឧស្ម័ន។ ខណៈពេលដែល NSTIs កម្រមានណាស់ ពួកវាបង្ហាញអត្រាមរណភាពខ្ពស់ដោយសារតែការវិវត្តយ៉ាងឆាប់រហ័សរបស់វា។ ការធ្វើរោគវិនិច្ឆ័យ និងការព្យាបាលទាន់ពេលវេលា និងសមស្របគឺជាគន្លឹះក្នុងការសម្រេចបានលទ្ធផលអំណោយផល ហើយ HBOT ត្រូវបានណែនាំជាវិធីសាស្ត្របន្ថែមសម្រាប់ការគ្រប់គ្រង NSTIs។ ទោះបីជានៅតែមានការជជែកវែកញែកជុំវិញការប្រើប្រាស់ HBOT ក្នុង NSTIs ដោយសារតែខ្វះការសិក្សាដែលគ្រប់គ្រងជាមុនក៏ដោយភស្តុតាងបង្ហាញថាវាអាចមានទំនាក់ទំនងជាមួយនឹងអត្រារស់រានមានជីវិតប្រសើរឡើង និងការអភិរក្សសរីរាង្គចំពោះអ្នកជំងឺ NSTIការសិក្សាមួយដែលបានពិនិត្យឡើងវិញបានបង្ហាញពីការថយចុះគួរឱ្យកត់សម្គាល់នៃអត្រាមរណភាពក្នុងចំណោមអ្នកជំងឺ NSTI ដែលទទួលបាន HBOT ។
១.៣ ការឆ្លងមេរោគនៅកន្លែងវះកាត់
ការឆ្លងមេរោគដែលបង្កឡើងដោយបាក់តេរី (SSIs) អាចត្រូវបានចាត់ថ្នាក់ដោយផ្អែកលើទីតាំងកាយវិភាគសាស្ត្រនៃការឆ្លងមេរោគ ហើយអាចកើតឡើងពីភ្នាក់ងារបង្ករោគផ្សេងៗ រួមទាំងបាក់តេរីអេរ៉ូប៊ីក និងបាក់តេរីអាណាអេរ៉ូប៊ីក។ បើទោះបីជាមានការរីកចម្រើនក្នុងវិធានការគ្រប់គ្រងការឆ្លងមេរោគ ដូចជាបច្ចេកទេសសម្លាប់មេរោគ ការប្រើប្រាស់ថ្នាំអង់ទីប៊ីយោទិកបង្ការ និងការកែលម្អការអនុវត្តការវះកាត់ក៏ដោយ ការឆ្លងមេរោគដែលបង្កឡើងដោយបាក់តេរី (SSIs) នៅតែជាផលវិបាកដែលនៅតែបន្តកើតមាន។
ការពិនិត្យឡើងវិញដ៏សំខាន់មួយបានស៊ើបអង្កេតពីប្រសិទ្ធភាពរបស់ HBOT ក្នុងការទប់ស្កាត់ SSIs ជ្រៅក្នុងការវះកាត់ scoliosis សរសៃប្រសាទ និងសាច់ដុំ។ HBOT មុនពេលវះកាត់អាចកាត់បន្ថយអត្រានៃ SSIs យ៉ាងច្រើន និងជួយសម្រួលដល់ការព្យាបាលរបួស។ ការព្យាបាលដែលមិនរាតត្បាតនេះបង្កើតបរិយាកាសមួយដែលកម្រិតអុកស៊ីសែននៅក្នុងជាលិការបួសត្រូវបានកើនឡើង ដែលត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងសកម្មភាពសម្លាប់អុកស៊ីតកម្មប្រឆាំងនឹងភ្នាក់ងារបង្ករោគ។ លើសពីនេះ វាដោះស្រាយកម្រិតឈាម និងអុកស៊ីសែនទាបដែលរួមចំណែកដល់ការវិវត្តនៃ SSIs។ ក្រៅពីយុទ្ធសាស្ត្រគ្រប់គ្រងការឆ្លងមេរោគផ្សេងទៀត HBOT ត្រូវបានណែនាំជាពិសេសសម្រាប់ការវះកាត់ដែលមានការបំពុលស្អាតដូចជានីតិវិធីពោះវៀនធំ និងរន្ធគូថ។
១.៤ ការរលាក
ការរលាកគឺជារបួសដែលបណ្តាលមកពីកំដៅខ្លាំង ចរន្តអគ្គិសនី សារធាតុគីមី ឬវិទ្យុសកម្ម ហើយអាចបង្កឱ្យមានអត្រាឈឺ និងស្លាប់ខ្ពស់។ HBOT មានប្រយោជន៍ក្នុងការព្យាបាលការរលាកដោយបង្កើនកម្រិតអុកស៊ីសែននៅក្នុងជាលិកាដែលខូច។ ខណៈពេលដែលការសិក្សាលើសត្វ និងគ្លីនិកបង្ហាញលទ្ធផលចម្រុះទាក់ទងនឹងប្រសិទ្ធភាពនៃ HBOT ក្នុងការព្យាបាលរលាកការសិក្សាមួយដែលពាក់ព័ន្ធនឹងអ្នកជំងឺរលាកចំនួន 125 នាក់បានបង្ហាញថា HBOT មិនបានបង្ហាញផលប៉ះពាល់គួរឱ្យកត់សម្គាល់លើអត្រាមរណភាព ឬចំនួននៃការវះកាត់ដែលបានធ្វើនោះទេ ប៉ុន្តែបានកាត់បន្ថយពេលវេលាព្យាបាលជាមធ្យម (19.7 ថ្ងៃបើប្រៀបធៀបទៅនឹង 43.8 ថ្ងៃ)។ ការរួមបញ្ចូល HBOT ជាមួយនឹងការគ្រប់គ្រងការរលាកដ៏ទូលំទូលាយអាចគ្រប់គ្រងការឆ្លងមេរោគក្នុងឈាមចំពោះអ្នកជំងឺរលាកបានយ៉ាងមានប្រសិទ្ធភាព ដែលនាំឱ្យមានពេលវេលាព្យាបាលខ្លីជាងមុន និងកាត់បន្ថយតម្រូវការសារធាតុរាវ។ ទោះជាយ៉ាងណាក៏ដោយ ការស្រាវជ្រាវបន្ថែមទៀតយ៉ាងទូលំទូលាយគឺត្រូវបានទាមទារដើម្បីបញ្ជាក់ពីតួនាទីរបស់ HBOT ក្នុងការគ្រប់គ្រងការរលាកយ៉ាងទូលំទូលាយ។
១.៥ ជំងឺរលាកឆ្អឹង
ជំងឺរលាកឆ្អឹង គឺជាការឆ្លងមេរោគនៃឆ្អឹង ឬខួរឆ្អឹង ដែលជារឿយៗបណ្តាលមកពីបាក់តេរីបង្ករោគ។ ការព្យាបាលជំងឺរលាកឆ្អឹងអាចជាការប្រឈមមួយ ដោយសារតែការផ្គត់ផ្គង់ឈាមទៅកាន់ឆ្អឹងមានកម្រិត និងការជ្រៀតចូលមានកម្រិតនៃថ្នាំអង់ទីប៊ីយោទិចទៅក្នុងខួរឆ្អឹង។ ជំងឺរលាកឆ្អឹងរ៉ាំរ៉ៃត្រូវបានកំណត់លក្ខណៈដោយភ្នាក់ងារបង្ករោគដែលនៅតែបន្ត ការរលាកស្រាល និងការបង្កើតជាលិកាឆ្អឹងដែលរលួយ។ ជំងឺរលាកឆ្អឹងដែលធន់នឹងការព្យាបាលសំដៅទៅលើការឆ្លងមេរោគឆ្អឹងរ៉ាំរ៉ៃ ដែលបន្ត ឬកើតឡើងវិញ ទោះបីជាមានការព្យាបាលត្រឹមត្រូវក៏ដោយ។
HBOT ត្រូវបានបង្ហាញថាធ្វើអោយប្រសើរឡើងគួរឱ្យកត់សម្គាល់នូវកម្រិតអុកស៊ីសែននៅក្នុងជាលិកាឆ្អឹងដែលឆ្លងមេរោគ។ ស៊េរីករណី និងការសិក្សាក្រុមអ្នកជំងឺជាច្រើនបង្ហាញថា HBOT បង្កើនលទ្ធផលគ្លីនិកសម្រាប់អ្នកជំងឺរលាកឆ្អឹង។ វាហាក់ដូចជាដំណើរការតាមរយៈយន្តការផ្សេងៗ រួមទាំងការជំរុញសកម្មភាពមេតាប៉ូលីស ការទប់ស្កាត់បាក់តេរីបង្ករោគ ការបង្កើនប្រសិទ្ធភាពថ្នាំអង់ទីប៊ីយោទិច ការកាត់បន្ថយការរលាក និងការលើកកម្ពស់ការព្យាបាល។ដំណើរការ។ ក្រោយការព្យាបាលដោយ HBOT អ្នកជំងឺ 60% ទៅ 85% ដែលមានជំងឺរលាកឆ្អឹងរ៉ាំរ៉ៃ និងធន់នឹងការព្យាបាលបង្ហាញសញ្ញានៃការបង្ក្រាបការឆ្លងមេរោគ។
១.៦ ការឆ្លងមេរោគផ្សិត
នៅទូទាំងពិភពលោក មនុស្សជាងបីលាននាក់ទទួលរងពីការឆ្លងមេរោគផ្សិតរ៉ាំរ៉ៃ ឬរាតត្បាត ដែលនាំឱ្យមានការស្លាប់ជាង 600,000 នាក់ជារៀងរាល់ឆ្នាំ។ លទ្ធផលនៃការព្យាបាលសម្រាប់ការឆ្លងមេរោគផ្សិតច្រើនតែត្រូវបានសម្របសម្រួលដោយសារតែកត្តាដូចជាស្ថានភាពភាពស៊ាំដែលបានផ្លាស់ប្តូរ ជំងឺមូលដ្ឋាន និងលក្ខណៈនៃភាពសាហាវនៃភ្នាក់ងារបង្ករោគ។ HBOT កំពុងក្លាយជាជម្រើសព្យាបាលដ៏គួរឱ្យទាក់ទាញក្នុងការឆ្លងមេរោគផ្សិតធ្ងន់ធ្ងរដោយសារតែសុវត្ថិភាព និងមិនរាតត្បាតរបស់វា។ ការសិក្សាបង្ហាញថា HBOT អាចមានប្រសិទ្ធភាពប្រឆាំងនឹងភ្នាក់ងារបង្ករោគផ្សិតដូចជា Aspergillus និង Mycobacterium tuberculosis។
HBOT ជំរុញប្រសិទ្ធភាពប្រឆាំងនឹងផ្សិតដោយរារាំងការបង្កើតជីវហ្វីមរបស់ Aspergillus ដោយប្រសិទ្ធភាពកើនឡើងត្រូវបានកត់សម្គាល់នៅក្នុងពូជដែលខ្វះហ្សែន superoxide dismutase (SOD)។ ស្ថានភាពកង្វះអុកស៊ីសែនអំឡុងពេលឆ្លងមេរោគផ្សិតបង្កបញ្ហាប្រឈមដល់ការចែកចាយថ្នាំប្រឆាំងនឹងផ្សិត ដែលធ្វើឱ្យកម្រិតអុកស៊ីសែនកើនឡើងពី HBOT ក្លាយជាអន្តរាគមន៍ដ៏មានសក្តានុពល ទោះបីជាការស្រាវជ្រាវបន្ថែមត្រូវបានទាមទារក៏ដោយ។
លក្ខណៈសម្បត្តិប្រឆាំងមេរោគរបស់ HBOT
បរិស្ថានដែលមានអុកស៊ីហ្សែនខ្ពស់ដែលបង្កើតឡើងដោយ HBOT ផ្តួចផ្តើមការផ្លាស់ប្តូរសរីរវិទ្យា និងជីវគីមីដែលជំរុញលក្ខណៈសម្បត្តិប្រឆាំងបាក់តេរី ដែលធ្វើឱ្យវាក្លាយជាការព្យាបាលបន្ថែមដ៏មានប្រសិទ្ធភាពសម្រាប់ការឆ្លងមេរោគ។ HBOT បង្ហាញពីឥទ្ធិពលគួរឱ្យកត់សម្គាល់ប្រឆាំងនឹងបាក់តេរីអេរ៉ូប៊ីក និងបាក់តេរីអាណាអេរ៉ូប៊ីកជាចម្បងតាមរយៈយន្តការដូចជាសកម្មភាពសម្លាប់បាក់តេរីដោយផ្ទាល់ ការបង្កើនការឆ្លើយតបប្រព័ន្ធភាពស៊ាំ និងឥទ្ធិពលសហការជាមួយភ្នាក់ងារប្រឆាំងមេរោគជាក់លាក់។
2.1 ផលប៉ះពាល់ដោយផ្ទាល់ប្រឆាំងនឹងបាក់តេរីនៃ HBOT
ឥទ្ធិពលប្រឆាំងបាក់តេរីដោយផ្ទាល់របស់ HBOT ភាគច្រើនត្រូវបានសន្មតថាជាការបង្កើតប្រភេទអុកស៊ីសែនដែលមានប្រតិកម្ម (ROS) ដែលរួមមានអានីយ៉ុងស៊ុយភឺរអុកស៊ីត អ៊ីដ្រូសែនប៉េរ៉ុកស៊ីត រ៉ាឌីកាល់អ៊ីដ្រូស៊ីល និងអ៊ីយ៉ុងអ៊ីដ្រូស៊ីល ដែលទាំងអស់នេះកើតឡើងក្នុងអំឡុងពេលមេតាបូលីសកោសិកា។
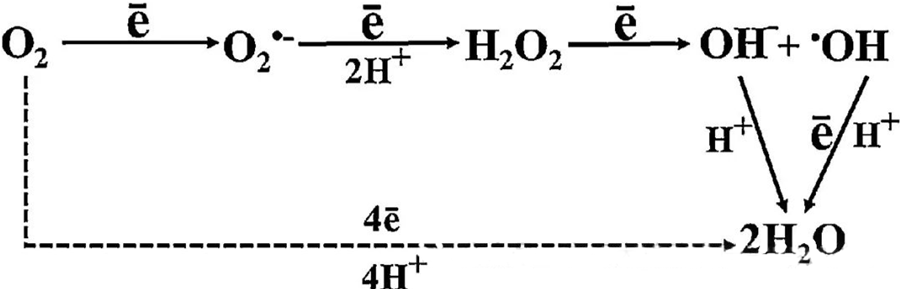
អន្តរកម្មរវាង O₂ និងសមាសធាតុកោសិកា គឺមានសារៈសំខាន់ណាស់ក្នុងការយល់ដឹងពីរបៀបដែល ROS បង្កើតឡើងនៅក្នុងកោសិកា។ ក្រោមលក្ខខណ្ឌជាក់លាក់ដែលហៅថាភាពតានតឹងអុកស៊ីតកម្ម តុល្យភាពរវាងការបង្កើត ROS និងការរិចរិលរបស់វាត្រូវបានរំខាន ដែលនាំឱ្យមានកម្រិតខ្ពស់នៃ ROS នៅក្នុងកោសិកា។ ការផលិត superoxide (O₂⁻) ត្រូវបានជំរុញដោយ superoxide dismutase ដែលក្រោយមកបំប្លែង O₂⁻ ទៅជាអ៊ីដ្រូសែន peroxide (H₂O₂)។ ការបំប្លែងនេះត្រូវបានពង្រីកបន្ថែមទៀតដោយប្រតិកម្ម Fenton ដែលកត់សុី Fe²⁺ ដើម្បីបង្កើតរ៉ាឌីកាល់ hydroxyl (·OH) និង Fe³⁺ ដោយហេតុនេះផ្តួចផ្តើមលំដាប់ redox ដែលបង្កគ្រោះថ្នាក់នៃការបង្កើត ROS និងការខូចខាតកោសិកា។
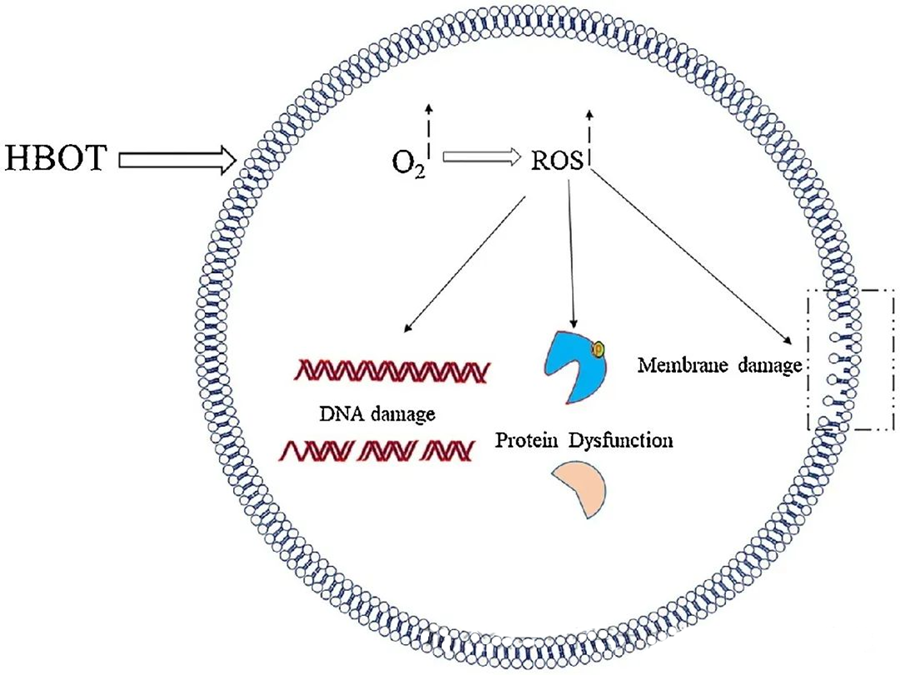
ផលប៉ះពាល់ពុលនៃ ROS ផ្តោតលើសមាសធាតុកោសិកាសំខាន់ៗដូចជា DNA, RNA, ប្រូតេអ៊ីន និង lipids។ ជាពិសេស DNA គឺជាគោលដៅចម្បងនៃភាពពុលកោសិកាដែលសម្របសម្រួលដោយ H₂O₂ ព្រោះវារំខានដល់រចនាសម្ព័ន្ធ deoxyribose និងបំផ្លាញសមាសធាតុមូលដ្ឋាន។ ការខូចខាតរាងកាយដែលបង្កឡើងដោយ ROS ពង្រីកដល់រចនាសម្ព័ន្ធ helix នៃ DNA ដែលអាចបណ្តាលមកពី lipid peroxidation ដែលបង្កឡើងដោយ ROS។ នេះគូសបញ្ជាក់ពីផលវិបាកអវិជ្ជមាននៃកម្រិត ROS កើនឡើងនៅក្នុងប្រព័ន្ធជីវសាស្រ្ត។
សកម្មភាពប្រឆាំងនឹងមេរោគរបស់ ROS
ROS ដើរតួនាទីយ៉ាងសំខាន់ក្នុងការរារាំងការលូតលាស់របស់អតិសុខុមប្រាណ ដូចដែលបានបង្ហាញតាមរយៈការបង្កើត ROS ដែលបង្កឡើងដោយ HBOT។ ផលប៉ះពាល់ពុលនៃ ROS ផ្តោតដោយផ្ទាល់ទៅលើសមាសធាតុកោសិកាដូចជា DNA ប្រូតេអ៊ីន និងជាតិខ្លាញ់។ កំហាប់ខ្ពស់នៃប្រភេទអុកស៊ីសែនសកម្មអាចបំផ្លាញជាតិខ្លាញ់ដោយផ្ទាល់ ដែលនាំឱ្យមានការកត់សុីជាតិខ្លាញ់។ ដំណើរការនេះធ្វើឱ្យខូចដល់ភាពសុចរិតនៃភ្នាសកោសិកា ហើយជាលទ្ធផល មុខងាររបស់ឧបករណ៍ទទួល និងប្រូតេអ៊ីនដែលទាក់ទងនឹងភ្នាស។
លើសពីនេះ ប្រូតេអ៊ីន ដែលក៏ជាគោលដៅម៉ូលេគុលសំខាន់ៗរបស់ ROS ឆ្លងកាត់ការកែប្រែអុកស៊ីតកម្មជាក់លាក់នៅសំណល់អាស៊ីតអាមីណូផ្សេងៗដូចជា ស៊ីស្តេអ៊ីន មេទីយ៉ូនីន ទីរ៉ូស៊ីន ហ្វេនីលអាឡានីន និងទ្រីបតូហ្វាន។ ឧទាហរណ៍ HBOT ត្រូវបានបង្ហាញថាបង្កឱ្យមានការផ្លាស់ប្តូរអុកស៊ីតកម្មនៅក្នុងប្រូតេអ៊ីនមួយចំនួននៅក្នុង E. coli រួមទាំងកត្តាលាតសន្ធឹង G និង DnaK ដោយហេតុនេះប៉ះពាល់ដល់មុខងារកោសិការបស់វា។
បង្កើនភាពស៊ាំតាមរយៈ HBOT
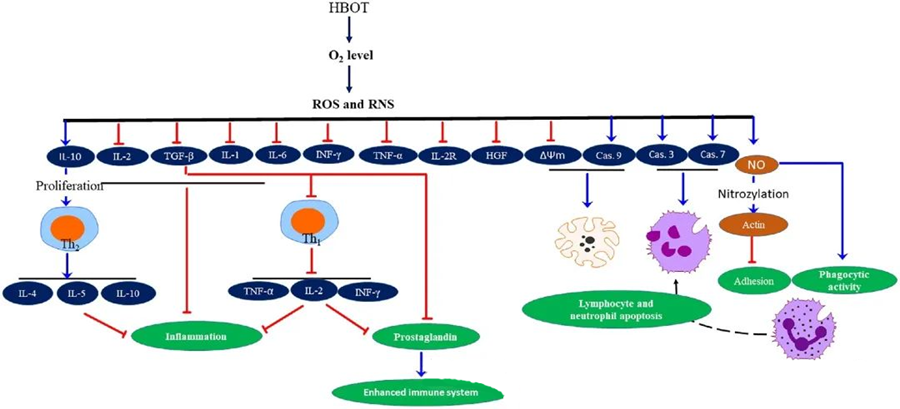
លក្ខណៈសម្បត្តិប្រឆាំងនឹងការរលាករបស់ HBOTត្រូវបានកត់ត្រាទុក ដែលបង្ហាញថាមានសារៈសំខាន់សម្រាប់ការកាត់បន្ថយការខូចខាតជាលិកា និងទប់ស្កាត់ការវិវត្តនៃការឆ្លងមេរោគ។ HBOT ប៉ះពាល់យ៉ាងខ្លាំងដល់ការបញ្ចេញមតិនៃ cytokines និងសារធាតុគ្រប់គ្រងការរលាកផ្សេងទៀត ដែលជះឥទ្ធិពលដល់ការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំ។ ប្រព័ន្ធពិសោធន៍ផ្សេងៗបានសង្កេតឃើញការផ្លាស់ប្តូរខុសៗគ្នានៅក្នុងការបញ្ចេញមតិហ្សែន និងការបង្កើតប្រូតេអ៊ីនក្រោយ HBOT ដែលបង្កើន ឬបន្ថយកត្តាលូតលាស់ និង cytokines។
ក្នុងអំឡុងពេលដំណើរការ HBOT កម្រិត O₂ កើនឡើងបង្កឱ្យមានការឆ្លើយតបកោសិកាជាច្រើន ដូចជាការទប់ស្កាត់ការបញ្ចេញសារធាតុសម្របសម្រួលរលាក និងជំរុញការស្លាប់កោសិកាឡាំហ្វូស៊ីត និងណឺត្រូហ្វីលក្នុងកោសិកា។ ជារួម សកម្មភាពទាំងនេះបង្កើនយន្តការប្រឆាំងមេរោគរបស់ប្រព័ន្ធភាពស៊ាំ ដោយហេតុនេះជួយសម្រួលដល់ការព្យាបាលការឆ្លងមេរោគ។
លើសពីនេះ ការសិក្សាបានបង្ហាញថា កម្រិត O₂ កើនឡើងក្នុងអំឡុងពេល HBOT អាចកាត់បន្ថយការបញ្ចេញមតិនៃ cytokines ដែលបង្កការរលាក រួមទាំង interferon-gamma (IFN-γ), interleukin-1 (IL-1) និង interleukin-6 (IL-6)។ ការផ្លាស់ប្តូរទាំងនេះក៏រួមបញ្ចូលទាំងការបន្ថយសមាមាត្រនៃកោសិកា T CD4:CD8 និងការកែប្រែ receptors រលាយផ្សេងទៀត ដែលនៅទីបំផុតបង្កើនកម្រិត interleukin-10 (IL-10) ដែលមានសារៈសំខាន់សម្រាប់ការប្រឆាំងនឹងការរលាក និងជំរុញការព្យាបាល។
សកម្មភាពប្រឆាំងមេរោគរបស់ HBOT មានទំនាក់ទំនងគ្នាជាមួយនឹងយន្តការជីវសាស្រ្តស្មុគស្មាញ។ ទាំង superoxide និងសម្ពាធខ្ពស់ត្រូវបានរាយការណ៍ថាជំរុញសកម្មភាពប្រឆាំងបាក់តេរីដែលបង្កឡើងដោយ HBOT និង apoptosis នៃ neutrophil ដោយមិនស៊ីសង្វាក់គ្នា។ បន្ទាប់ពី HBOT ការកើនឡើងគួរឱ្យកត់សម្គាល់នៃកម្រិតអុកស៊ីសែនបង្កើនសមត្ថភាពសម្លាប់បាក់តេរីរបស់ neutrophils ដែលជាសមាសធាតុសំខាន់នៃការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំ។ លើសពីនេះ HBOT ទប់ស្កាត់ការស្អិតជាប់របស់ neutrophil ដែលត្រូវបានសម្របសម្រួលដោយអន្តរកម្មនៃ β-integrins លើ neutrophils ជាមួយនឹងម៉ូលេគុលស្អិតជាប់អន្តរកោសិកា (ICAM) លើកោសិកា endothelial។ HBOT រារាំងសកម្មភាពរបស់ neutrophil β-2 integrin (Mac-1, CD11b/CD18) តាមរយៈដំណើរការដែលសម្របសម្រួលដោយអុកស៊ីដអាសូត (NO) ដែលរួមចំណែកដល់ការធ្វើចំណាកស្រុករបស់ neutrophils ទៅកាន់កន្លែងនៃការឆ្លងមេរោគ។
ការរៀបចំឡើងវិញយ៉ាងច្បាស់លាស់នៃគ្រោងឆ្អឹងកោសិកាគឺចាំបាច់សម្រាប់ណឺត្រូហ្វីលដើម្បីធ្វើឱ្យបាក់តេរីបង្កជំងឺ phagocytize ប្រកបដោយប្រសិទ្ធភាព។ S-nitrosylation នៃអាកទីនត្រូវបានបង្ហាញថាជំរុញការបង្កើតប៉ូលីមែរអាកទីន ដែលអាចសម្រួលដល់សកម្មភាព phagocytic នៃនឺត្រូហ្វីលបន្ទាប់ពីការព្យាបាលជាមុនដោយ HBOT។ លើសពីនេះ HBOT ជំរុញ apoptosis នៅក្នុងខ្សែកោសិកា T របស់មនុស្សតាមរយៈផ្លូវមីតូខនឌ្រី ជាមួយនឹងការរាយការណ៍អំពីការស្លាប់របស់ឡាំហ្វូស៊ីតលឿនបន្ទាប់ពី HBOT។ ការទប់ស្កាត់ caspase-9 ដោយមិនប៉ះពាល់ដល់ caspase-8 បានបង្ហាញពីប្រសិទ្ធភាពនៃប្រព័ន្ធភាពស៊ាំរបស់ HBOT។
ផលប៉ះពាល់សហការនៃ HBOT ជាមួយនឹងភ្នាក់ងារប្រឆាំងមេរោគ
នៅក្នុងកម្មវិធីព្យាបាល HBOT ត្រូវបានគេប្រើជាញឹកញាប់រួមជាមួយថ្នាំអង់ទីប៊ីយោទិក ដើម្បីប្រយុទ្ធប្រឆាំងនឹងការឆ្លងមេរោគប្រកបដោយប្រសិទ្ធភាព។ ស្ថានភាពអុកស៊ីហ្សែនលើសដែលសម្រេចបានក្នុងអំឡុងពេល HBOT អាចមានឥទ្ធិពលលើប្រសិទ្ធភាពនៃភ្នាក់ងារថ្នាំអង់ទីប៊ីយោទិកមួយចំនួន។ ការស្រាវជ្រាវបង្ហាញថា ថ្នាំសម្លាប់បាក់តេរីជាក់លាក់ ដូចជា β-lactams, fluoroquinolones និង aminoglycosides មិនត្រឹមតែធ្វើសកម្មភាពតាមរយៈយន្តការដែលមាននៅក្នុងខ្លួនប៉ុណ្ណោះទេ ប៉ុន្តែវាក៏ពឹងផ្អែកមួយផ្នែកទៅលើការរំលាយអាហារបែប aerobic របស់បាក់តេរីផងដែរ។ ដូច្នេះ វត្តមាននៃអុកស៊ីសែន និងលក្ខណៈមេតាបូលីសរបស់ភ្នាក់ងារបង្ករោគ គឺជាកត្តាសំខាន់នៅពេលវាយតម្លៃប្រសិទ្ធភាពព្យាបាលនៃថ្នាំអង់ទីប៊ីយោទិក។
ភស្តុតាងសំខាន់ៗបានបង្ហាញថា កម្រិតអុកស៊ីសែនទាបអាចបង្កើនភាពធន់របស់បាក់តេរី Pseudomonas aeruginosa ទៅនឹង piperacillin/tazobactam ហើយបរិស្ថានអុកស៊ីសែនទាបក៏រួមចំណែកដល់ភាពធន់របស់ Enterobacter cloacae ទៅនឹង azithromycin កាន់តែខ្លាំងផងដែរ។ ផ្ទុយទៅវិញ ស្ថានភាពកង្វះអុកស៊ីសែនមួយចំនួនអាចបង្កើនភាពរសើបរបស់បាក់តេរីចំពោះថ្នាំអង់ទីប៊ីយោទិក tetracycline។ HBOT បម្រើជាវិធីសាស្ត្រព្យាបាលបន្ថែមដែលអាចអនុវត្តបានដោយការបង្កើតមេតាបូលីស aerobic និងបង្កើតឡើងវិញនូវជាលិកាដែលឆ្លងមេរោគដែលមានកង្វះអុកស៊ីសែន ដែលបន្ទាប់មកបង្កើនភាពរសើបរបស់ភ្នាក់ងារបង្ករោគចំពោះថ្នាំអង់ទីប៊ីយោទិក។
នៅក្នុងការសិក្សាមុនព្យាបាល ការរួមបញ្ចូលគ្នានៃ HBOT—ដែលត្រូវបានគ្រប់គ្រងពីរដងក្នុងមួយថ្ងៃរយៈពេល 8 ម៉ោងក្នុងសម្ពាធ 280 kPa—រួមជាមួយ tobramycin (20 mg/kg/ថ្ងៃ) បានកាត់បន្ថយបន្ទុកបាក់តេរីយ៉ាងច្រើននៅក្នុងជំងឺរលាកស្រទាប់បេះដូងដែលឆ្លងមេរោគ Staphylococcus aureus។ នេះបង្ហាញពីសក្តានុពលរបស់ HBOT ជាការព្យាបាលជំនួយ។ ការស៊ើបអង្កេតបន្ថែមបានបង្ហាញថា ក្រោមសីតុណ្ហភាព 37°C និងសម្ពាធ 3 ATA រយៈពេល 5 ម៉ោង HBOT បានបង្កើនប្រសិទ្ធភាពនៃ imipenem ប្រឆាំងនឹង Pseudomonas aeruginosa ដែលឆ្លងមេរោគ macrophage។ លើសពីនេះ ការរួមបញ្ចូលគ្នានៃ HBOT ជាមួយ cephazolin ត្រូវបានគេរកឃើញថាមានប្រសិទ្ធភាពជាងក្នុងការព្យាបាលជំងឺរលាកឆ្អឹង Staphylococcus aureus ក្នុងគំរូសត្វបើប្រៀបធៀបទៅនឹង cephazolin តែម្នាក់ឯង។
HBOT ក៏បង្កើនសកម្មភាពសម្លាប់បាក់តេរីរបស់ ciprofloxacin យ៉ាងខ្លាំងប្រឆាំងនឹងជីវស្រទាប់ Pseudomonas aeruginosa ជាពិសេសបន្ទាប់ពីការប៉ះពាល់រយៈពេល 90 នាទី។ ការបង្កើនប្រសិទ្ធភាពនេះត្រូវបានសន្មតថាជាការបង្កើតប្រភេទអុកស៊ីសែនដែលមានប្រតិកម្មខាងក្នុង (ROS) និងបង្ហាញពីភាពរសើបកាន់តែខ្លាំងនៅក្នុងការផ្លាស់ប្តូរហ្សែនដែលមានបញ្ហា peroxidase។
នៅក្នុងគំរូនៃជំងឺរលាកស្រោមសួតដែលបណ្តាលមកពី Staphylococcus aureus ដែលធន់នឹង methicillin (MRSA) ឥទ្ធិពលសហការនៃ vancomycin, teicoplanin និង linezolid ជាមួយ HBOT បានបង្ហាញពីប្រសិទ្ធភាពកើនឡើងគួរឱ្យកត់សម្គាល់ប្រឆាំងនឹង MRSA។ Metronidazole ដែលជាថ្នាំអង់ទីប៊ីយោទិចដែលត្រូវបានប្រើប្រាស់យ៉ាងទូលំទូលាយក្នុងការព្យាបាលការឆ្លងមេរោគអាណាអេរ៉ូប៊ីក និងពហុមីក្រូបធ្ងន់ធ្ងរដូចជាការឆ្លងមេរោគជើងទឹកនោមផ្អែម (DFIs) និងការឆ្លងមេរោគនៅកន្លែងវះកាត់ (SSIs) បានបង្ហាញពីប្រសិទ្ធភាពប្រឆាំងមេរោគខ្ពស់ជាងនៅក្រោមលក្ខខណ្ឌអាណាអេរ៉ូប៊ីក។ ការសិក្សានាពេលអនាគតគឺចាំបាច់ដើម្បីស្វែងយល់ពីប្រសិទ្ធភាពប្រឆាំងបាក់តេរីសហការនៃ HBOT រួមផ្សំជាមួយ metronidazole ទាំងនៅក្នុង vivo និងនៅក្នុង vitro។
ប្រសិទ្ធភាពប្រឆាំងមេរោគរបស់ HBOT លើបាក់តេរីដែលធន់នឹងថ្នាំ
ជាមួយនឹងការវិវត្តន៍ និងការរីករាលដាលនៃពូជដែលធន់នឹងថ្នាំអង់ទីប៊ីយ៉ូទិកប្រពៃណីច្រើនតែបាត់បង់ប្រសិទ្ធភាពរបស់វាតាមពេលវេលា។ លើសពីនេះ HBOT អាចបង្ហាញថាមានសារៈសំខាន់ក្នុងការព្យាបាល និងការពារការឆ្លងមេរោគដែលបណ្តាលមកពីភ្នាក់ងារបង្ករោគដែលធន់នឹងថ្នាំច្រើនមុខ ដែលបម្រើជាយុទ្ធសាស្ត្រសំខាន់នៅពេលដែលការព្យាបាលដោយថ្នាំអង់ទីប៊ីយ៉ូទិកបរាជ័យ។ ការសិក្សាជាច្រើនបានរាយការណ៍ពីផលប៉ះពាល់បាក់តេរីសំខាន់ៗរបស់ HBOT ទៅលើបាក់តេរីដែលធន់នឹងថ្នាំដែលពាក់ព័ន្ធខាងគ្លីនិក។ ឧទាហរណ៍ វគ្គ HBOT រយៈពេល 90 នាទីនៅ 2 ATM បានកាត់បន្ថយការលូតលាស់របស់ MRSA យ៉ាងច្រើន។ លើសពីនេះ នៅក្នុងគំរូសមាមាត្រ HBOT បានបង្កើនប្រសិទ្ធភាពប្រឆាំងនឹងបាក់តេរីនៃថ្នាំអង់ទីប៊ីយ៉ូទិកផ្សេងៗប្រឆាំងនឹងការឆ្លងមេរោគ MRSA។ របាយការណ៍បានបញ្ជាក់ថា HBOT មានប្រសិទ្ធភាពក្នុងការព្យាបាលជំងឺរលាកឆ្អឹងដែលបណ្តាលមកពី Klebsiella pneumoniae ដែលផលិត OXA-48 ដោយមិនចាំបាច់ប្រើថ្នាំអង់ទីប៊ីយ៉ូទិកបន្ថែមណាមួយឡើយ។
សរុបមក ការព្យាបាលដោយអុកស៊ីសែនសម្ពាធខ្ពស់ (hyperbaric oxygen) តំណាងឱ្យវិធីសាស្រ្តចម្រុះមួយក្នុងការគ្រប់គ្រងការឆ្លងមេរោគ ដោយបង្កើនការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំ ខណៈពេលដែលក៏បង្កើនប្រសិទ្ធភាពនៃភ្នាក់ងារប្រឆាំងមេរោគដែលមានស្រាប់ផងដែរ។ ជាមួយនឹងការស្រាវជ្រាវ និងការអភិវឌ្ឍដ៏ទូលំទូលាយ វាមានសក្តានុពលក្នុងការកាត់បន្ថយផលប៉ះពាល់នៃភាពធន់នឹងថ្នាំអង់ទីប៊ីយោទិក ដែលផ្តល់នូវក្តីសង្ឃឹមក្នុងការប្រយុទ្ធប្រឆាំងនឹងការឆ្លងមេរោគបាក់តេរី។
ពេលវេលាបង្ហោះ៖ ថ្ងៃទី ២៨ ខែកុម្ភៈ ឆ្នាំ ២០២៥

